多肽和蛋白的相互作用
检测与某一多肽相互作用的物质,最简单的方法就是利用此多肽做亲和pull-down实验,然后直接检测结合蛋白。蛋白质体外结合(Pull-down)试验可用于验证蛋白-蛋白相互作用的存在(经由别的研究方法预测过的,如免疫共沉淀)和作为一种初级的筛选试验来识别一些未知的蛋白-蛋白相互作用。通过竞争性阻断结合,合成肽通常被用来验证被假设的蛋白质-蛋白质相互作用。
生物素标记肽含有一个特殊的功能区和相当于参照的未修饰肽,此肽可被锚定在亲和素共轭的磁珠上,将这些磁珠与目标样本共同孵育(如核提取物或纯化的重组蛋白),通过洗涤去除未结合的蛋白,然后洗脱结合的蛋白质, SDS/ PAGE分析,经蛋白染色即可直接观察。通过比较分别与修饰和未修饰多肽相结合的蛋白质,即有可能确定候选者,即特定功能蛋白的“reader”蛋白。
带有一些特殊修饰的生物素标记肽可以通过化学合成,纯度达80%以上。肽长度应该在15-20个氨基酸。目标修饰位于序列中间时,两翼氨基酸残基不能少于6-8个。一般情况下,生物素多被偶联在N末端或C末端。如果无特殊要求,我们建议生物素偶联至N-末端,其优势是修饰的成功率更高,生产的时间更短,并且易于操作。此外,如果偶联至C-末端,需要额外增加一个赖氨酸。
生物素标记肽的Pull-down实验方案
生物素标记肽可与亲和素磁珠共轭以生成树脂,用于肽pulldown试验。先把生物素标记肽上样至Immobilized streptavidin beads (Pierce) 锚定有亲和素的磁珠上,再与细胞裂解液孵育。细胞裂解于1%(v/v)Nonidet P-40, 150 mM sodium chloride, 50 mM Tris-HCl, pH 7.5, protease inhibitors (Complete Tablets, Roche Applied Science),
加入 1 mM sodium orthovanadate作为磷酸酶抑制剂。等量的蛋白质分别与被锚定的多肽在4℃孵育6小时。经过大量洗涤,在SDS样品buffer中煮沸,结合蛋白可从被锚定的多肽洗脱下来,或者,用50 mM dithiothreitol将多肽与蛋白复合物从磁珠中断开。将来自活性肽和对照目标肽pull-downs的洗脱液合并,以作进一步的分析。
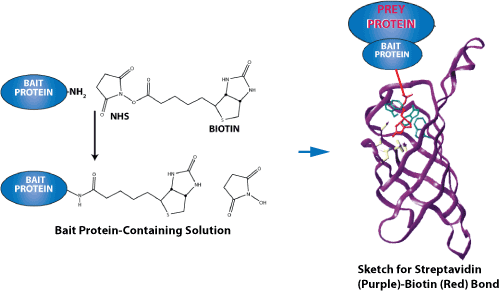
上图为链霉亲和素-生物素键力测量示意图。由于它们异常高的亲和结合性,其中最突出的配体-受体对是链霉亲和素-生物素(streptavidin-biotin)和亲和素-生物素(avidin-biotin)。 这两种蛋白质都有一个四聚体的结构,这样他们可以结合4个配体。
肽结合特性
hsp70(相对分子质量为70K的热休克蛋白)仅可识别未折叠蛋白。为了研究蛋白相互作用中每个氨基酸的偏好,Gregory C. Flynn等学者用人工合成的随机序列多肽去替代免疫球蛋白结合蛋白质(BiP)的结合位点。结果发现,BiP的结合位点表现出相当大的特异性。
- 多肽长度:7个氨基酸的多肽与hsp70家族结合的最好。通常6-10个氨基酸的多肽即可很好地结合。增加多肽的长度并不能增加其结合的特异性。
- 氨基酸偏好:能够与BiP复合物结合的多肽链普遍显示含有丰富的脂肪族氨基酸,如甘氨酸(Glycine)、(Alanine)、缬氨酸(Valine)、亮氨酸(Leucine)、异亮氨酸(Isoleucine)和脯氨酸(Proline)。
- 在BIP复合物中含量最丰富的是亮氨酸(Leucine),说明亮氨酸在蛋白结合中的重要作用。
- 无支链的氨基酸(如蛋氨酸(Methionine))和支链远离主干的氨基酸(如亮氨酸(Leucine))往往倾向于与BiP结合。这可能是因为侧链的灵活性和疏水性有利于结合。
- 即使具有最强的疏水性,但由于芳香族类氨基酸(苯丙氨酸(Phenylalanine)、酪氨酸(Tyrosine)、色氨酸(Tryptophan))不具有灵活的侧链,因而对结合来说并不太重要。
- 任意含1.6个脂肪族氨基酸残基的7肽匀可高效与BiP结合。
参考文献: Gregory C. Flynn, Jan Pohl, Mark T. Flocco & James E. Rothman. Peptide-binding specificity of the molecular chaperone BiP. 24 October 1991, Nature 353, 726-730 doi:10.1038/353726a0.
|



